Biyokütle, insanlığın ateşi bulduğu zamandan buyana
kullanıla gelen bir enerji kaynağıdır.Uzun yıllardan beri İnsanlık fosilleşmiş
biyokütleden kömür olarak yararlanmaktadır. Bu fosil yakıtı, biyokütledeki
şeker moleküllerinin çok yavaş ve çok uzun süren kimyasal reaksiyonlarla
lignine benzer bileşiklere dönüşmesiyle oluşur. Kömürde biyokütleden daha fazla
kimyasal bağlar olduğundan enerjisi daha yüksektir. Tüm fosil yakıtları (kömür,
petrol, doğal gaz) çok yaşlı biyokütlelerdir; bunlar da hidrojen ve karbon
içerir, ancak oluşumları için çok çok uzun zamanlara ve jeolojik olaylara gerek
olduğundan yenilenebilir enerji kaynakları olarak kabul edilmezler.
Biyokütle ve fosil yakıtları arasındaki diğer önemli bir
farklılık ta çevreye olan etkileridir. Bir bitki parçalandığında kimyasal
bileşenlerinin çoğunu atmosfere geri verir. Oysa fosil yakıtları yerin
derinliklerinde hapsedilmiştir, yanmadıkça atmosfere herhangi bir etkisi olmaz.
Örneğin odun en çok bilinen bir biyokütledir, yandığında güneş ışınlarından
ağacın aldığı enerjiyi geri verir.
Günümüzde biyokütle kullanımı evlerdeki ısıtma araçlarından
otomotiv yakıtlara, hatta bilgisayar pil yakıtlarına kadar uzanmaktadır.
Biyokütle üzerindeki çalışmalar ve teknolojik araştırmalar özellikle 1970
yıllarında başgösteren petrol kriziyle yeni bir boyut kazanmıştır. Günümüzde
çeşitli biyokütle dönüştürme prosesleri
uygulanmaktadır.
Biyokütle kaynakları, hampetrol kaynaklarından daha pahalıya
elde edilir; ancak biyokütle yenilenir bir kaynaktır, dolayısıyla azalan fosil
yakıtların yanında sürdürülebilir bir enerji kaynağı olması gibi bir avantaja
sahiptir. Biyokültenin gazlaştırılması ile elde edilen biyogaz, doğal gaz ve
LPG yerine kullanılabilecek özelliklerde bir gazdır.
Biyokütle, özellikle selülozik veya ligno-selülozik
yenilenir özellikteki organik maddelerdir; orman ve zirai ürün kalıntı ve
atıkları, odun ve atıkları, hayvansal atıklar, kentsel ve endüstri atıkları
gibi. Biyokütleden elde edilen yakıtlarla çalışan, örneğinin dizel motorları,
gaz türbinleri, ısıtıcı kazanları gibi sistemler çevreyi kirletmeyen, sadece
atmosferdeki CO2 ve N2 gazlarını dengede tutan emisyonlar
çıkardıklarından “yeşil” enerji üreticileri, bu tür yakıtlar da “yenilenebilir”
yakıtlardır. Yenilenebilir enerji kaynakları, biyokütle, rüzgar gücü,
hidroelektrik güç, jeotermal güç ve fotovoltaiklerdir.
Halen Dünya enerji tüketiminin ~%14 ünü oluşturan biyokütle
geleceğin önemli yenilenebilir enerji kaynaklarından biridir. Gelişmekte olan
ülkelerde tüketilen prtalama enerjinin %38 kadarı, hatta bazı ülkelerde %90’ı
biyokütleden sağlanmaktadır. Biyokütlenin, gelecek yüzyıl içinde de önemli bir
enerji kaynağı olma özelliğinin koruyacağı düşünülmektedir.
Biyoenerji, biyokütlenin enerjiye dönüştürülmüş halidir;
organik maddedeki kompleks karbonhidratlar enerji haline geçer (Şekil-1).
Biyokütle: Yerüstü ve yeraltında yaşayan ve ölen
organik maddelerin de içinde bulunduğu biyolojik orijinli maddelerdir; örneğin,
ağaçlar ve ağaç döküntüleri, ekin, otlar, saman, ve kuru otlar, kökler, hayvan
kalıntıları ve hayvan atıkları gibi.
Biyogaz: Karasal alanda organik maddelerin anaerobik
parçalanmasıyla meydana gelen gaz.
Biyoyakıt: Enerji üretiminde kullanılan bazı
yakıtlardır; odun, atıklar ve alkoller gibi.
6 .4 .1. Özellikleri
1. Biyokütle
Biyokütle genellikle ve hatalı bir biçimde düşük statülü bir
yakıt kaynağı olarak tanınır ve pek çok ülkede istatistiklere bile alınmaz.
Oysa, biyokütle modern fırınlarda doğrudan doğruya yakılarak ısı ve elektrik
üretilebilir, araçlarda kullanılabilen
etanol veya diğer alkol bazlı yakıtlara dönüştürülebilir.
Biyokütle kaynakları, yenilenir ve organik bazlıdır;
selülozlar (%38-50), hemiselülozlar (%23-32) ve lignin (%15-25 ) üç büyük temel
biyokütle kaynağıdır. Biyokütlenin bileşimi içerdiği maddelere göre değişir.
Bitkilerde %25 kadar lignin ve %75 kadar da karbonhidratlar vardır; karbonhidratlar,
uzun polimer zincirleri halinde birbirlerine bağlanmış çok sayıda şeker
molekülleridir. İki önemli karbonhidrat sınıfı selüloz ve hemi
(yarı)-selülozlardır.
Ligninlerde şeker molekülleri bulunmaz. Doğa, bitkilerin
dayanıklı fiberli dokularını oluştururken uzun selüloz polimerleri kullanır;
lignin kısmı ise selüloz fiberleri birarada tutan yapıştırıcı görevi yapar.
Tablo-1 biyokütlenin bileşimini, Tablo-2 biyokütle ve bazı
fosil yakıtların kimyasal ve fiziksel özelliklerini göstermektedir.
Tablo-1:
Biyokütlenin kimyasal bileşimi
BİYOENERJİ
HAMMADDELER
|
Selüloz, %
|
Hemiselüloz, %
|
Lignin, %
|
Mısır koçanı
|
35
|
28
|
16-21
|
Tatlı süpürgeotu (sorgum)
|
27
|
25
|
11
|
Şeker kamışı posası
|
32-48
|
19-24
|
23-32
|
Sert odun
|
45
|
30
|
20
|
Yumuşak odun
|
42
|
21
|
26
|
Melez kavak
|
42-56
|
18-25
|
21-23
|
Bambu
|
41-49
|
24-28
|
24-26
|
Çayır
|
44-51
|
42-50?
|
13-20
|
Kütük
|
44
|
24
|
17
|
Kamış türler
|
31
|
30
|
21
|
Tablo-2: Biyoenerji Hammaddeler, Biyoyakıtlar ve Fosil Yakıtların
Tipik Kimyasal ve Fiziksel Özellikleri
Kimyasal Özellikler
|
Fiziksel
Özelik
|
||||||
ID, GJ/t
|
Kül, %
|
S, %
|
K, %
|
EN: C
|
SL, m
|
d,
kg/m3
|
|
BİYOENERJİ HAMMADDELER
|
|||||||
Mısır koçanı
|
17.6
|
5.6
|
1.5
|
||||
Tatlı süpürge otu
|
15.4
|
5.5
|
|||||
Şeker k. posası
|
18.1
|
3.2-5.5
|
0.10-0.15
|
0.73-0.97
|
1.7
|
50-75
|
|
Şeker k. yaprağı
|
17.4
|
7.7
|
25-40
|
||||
Sert odun
|
20.5
|
0.45
|
0.009
|
0.04
|
1.2
|
||
Yumuşak odun
|
19.6
|
0.3
|
0.01
|
||||
Melez kavak
|
19.0
|
0.5-1.5
|
0.03
|
0.3
|
1350
|
1-1.4
|
150
|
Bambu
|
18.5-19.4
|
0.8-2.5
|
0.03-0.05
|
0.15-0.50
|
1.5-3.2
|
||
Çayır
|
18.3
|
4.5-5.8
|
0.12
|
1016
|
108
|
||
Kütük
|
17.1-19.4
|
1.5-4.5
|
0.1
|
0.37-1.12
|
1090
|
70-100
|
|
Kamış türler
|
17.1
|
5-6
|
0.07
|
1.2
|
|||
SIVI BİYOYAKITLAR
|
|||||||
Biyoetanol
|
28
|
<0.01
|
|||||
Biyodizel
|
40
|
<0.02
|
<0.05
|
<0.0001
|
|||
FOSİL YAKITLAR
|
|||||||
Kömür
|
15-30
|
1-20
|
0.5-3.0
|
0.02-0.3
|
~1300
|
||
Petrol
|
42-45
|
0.5-1.5
|
0.2-1.2
|
||||
ID: Isı değeri
(gross), S: sülfür, K: potasyum,
EN: külün erime
noktası, SL: selüloz lif uzunluğu,
d: hasatta
kesilmiş kırıntıların yoğunluğu
1 btu (British
Termal Unit) = 1.054 kJ , 1
kalori = 4.19 J
1 kWh = 3600 J, 1 W = 1 Js, G = giga = 109
Sınıflandırma
Enerji üretiminde kullanılan biyokütle kaynakları çok
çeşitlidir. Biyokütle enerji kullanımı modern veya geleneksel olmak üzere iki
genel sınıfta toplanabilir. Modern biyokütle kullanımı, konvensiyonal fosil
yakıtlarının yerini alacak kadar geniş uygulama alanlarını kapsar; enerji
ormancılığı, enerji bitkileri tarımı, orman ve tarım atıkları, hayvansal
atıklar. kentsel atıklar ve tarıma dayalı endüstri atıkları önemli biyokütle
elemanlarıdır. Geleneksel biyokütle kullanımı sınırlıdır, bunlar doğrudan
kullanılan odun, odun kömürü, pirinç kabuğu ve diğer bitki kalıntıları ile
hayvan gübreleridir.
a. Özel Tarım Ürünleri ve Tarım Kalıntıları
Enerji kaynağı olarak özellikle yetiştirilen pek çok tarım
ürünü vardır; şeker kamışı, mısır, buğday, süpürge otu, ayçiçeği, kolza tohumu
ve soya fasulyesi. Bu ürünler, etanol veya biyodizel gibi sıvı yakıtların elde
edilmesinde çok uygun biyokütle kaynaklarıdır.
Tohumlu bitkiler fazla miktarlarda yağ içerirler, ezilip
ekstrakt edilerek ayrılan yağ ya doğrudan veya esterleştirildikten sonra ısıtma
yağı veya dizel yağı (biyodizel) olarak kullanılabilir.
Biyodizel üretimine uygun çeşitli ürünler vardır, ancak en
elverişli olanı kolza tohumudur; diğer hammaddeler arasında hurma yağı,
ayçiçeği yağı, soya fasulyesi yağı, donyağı (hayvansal fat) ve balık yağlarıdır.
Bazı bitkisel yağların kalori değerleri dizel yağınınkinden (38.5 GJ/ton) daha
fazladır veya kıyaslanabilir düzeydedir; örneğin, kolza tohumunun 40.4 GJ/ton,
aspurun (yalancı safran) 39.7 GJ/ton, ayçiçeğinin 39.7 GJ/ton dur.
Dünyada çok büyük miktarlarda tarım ürünü kalıntısı
çıkmaktadır; bunlardan en fazla olanı pirincin ağırlıkça %25 ini oluşturan
pirinç kabuğudur. Diğer önemli kalıntılar arasında şeker kamışı posası,
hindistan cevizi kabuğu, hurma lifleri, yerfıstığı kabuğu, hububat samanları
sayılabilir.
b. Özel Orman Ürünleri ve Orman Kalıntıları
Ağaç dünyanın her yerinde temel enerji kaynağıdır. Orman
ürünlerinden enerji kaynağı olarak yararlanılan en uygun ağaçlar hızlı büyüyen,
çalılık veya koruluklardır; bunlar 2-5 yıl gibi kısa zaman aralıklarıyla hasat
edilebilen ve tekrar aynı kökler üzerinde büyüyen ağaçlardır. Odun doğrudan
yakılarak ısı ve enerji alınır, veya buhar ve elektrik üretilir, veya odun
kömürü yapılabilir.
Orman ürünleri kalıntıları orman, koru ve fidanlıklardaki
ağaçların budanması, ağaçlıklı yolların temizlenmesi, kereste ve benzeri
malzeme yapımı kalıntıları ve doğal aşınma sonucu oluşan kalıntılar gibi çok
çeşitlidir. Ağaç işleme de fazla miktarlarda kalıntı bırakır; bunlar da özel
yetiştirilen orman ürünleri kadar önemli biyoenerji kaynaklarıdır.
c. Hayvansal atıklar
Biyokütle enerji kaynağı olarak kullanılan çok sayıda
hayvansal atık vardır. En yaygın olanları domuz, tavuk ve sığır gübreleridir;
çünkü bu hayvanlar çok sayılarda beslenir. Bu atıklar anaerobik parçalanmayla
“biyogaz”a dönüştürülür; biyogazdan, doğrudan ısıtma yakıtı olarak veya
hidrojen elde edilerek elektrik akımı üretiminde yararlanılır.
d. Kentsel Katı Atıklar ve Evsel Atıklar
Kentsel katı atıklar yerleşim alanları ve atık toplama
servis tipine göre farklılıklar gösteren karışımlardır. Bu kaynaklar doğruda
yakılarak veya doğal anaerobik bozunmayla enerjiye dönüştürülebilir.
Evsel attıklar da hayvansal atıklar gibi biyokütle enerji
kaynağıdır, anaerobik bozunmayla biyogaz elde edilir. Kalan katı kısım yakılır,
veya pirolizi işlemiyle daha fazla biyogaz ve biyoyağ üretilir.
e. Endüstriyel Atıklar
Endüstriyel atıklardan anaerobik bozundurmayla biyogaz, veya
fermantasyonla etanol gibi enerji kaynakları elde edilebilir.
Önemli biyokütle enerji kaynaklarından biri de, et ve et
ürünlerinin işlenmesinden şekerli ürünlere kadar geniş bir yelpazesi olan
yiyecek endüstrisinden çıkan çeşitli katı ve sıvı atıklar ve yan ürünlerdir.
Katı atıklar olarak, meyve ve sebzelerin soyulmuş veya
temizlenmiş kabukları, kalite kontrol standartlarına uygun olmayan yiyecekler,
şeker ve nişasta ekstraksiyonundan arta kalan katı kısımlar, süzüntülerden
kalan posalar, v.s., sayılabilir.
Sıvı atıklar et, meyva ve sebzelerin yıkama suları,
beyazlatma suları, haşlanmış ürün ve balık yıkama suları, v.s., gibi. Bunlar
şeker, nişasta ve diğer suda çözünen maddelerle seyreltik halde katı maddeler
içerirler.
Şeker kamışı endüstrisinden büyük hacimlerde atık posa
çıkar. Bu fabrikalarının çoğunda atık posa, elektrik üretiminde kullanılan
buharın elde edildiği buhar kazanlarında yakıt olarak kullanılır.
Kağıt ve kağıt hamuru endüstrisinden çıkan atık madde “kara
alkol” pirolizlenerek veya gazlaştırılarak sıvı (biyoyağ) veya gaz
yakıtlar elde edilebilir. Biyoyağ işlenerek
biyodizel özelliğinde yakıta dönüştürülebilir.
2. Biyoenerji
Atmosferdeki CO2 ile yeryüzünde bulunan su fotosentez yoluyla birleşerek, biyokütleyi yapılandıran karbonhidratları meydana getirirler. Fotosentez olayını yürüten güneş enerjisi biyokütlede kimyasal bileşikler halinde depolanmıştır; biyokütle yakıldığında bu bileşikler atmosferdeki oksijenle karbon dioksit ve su vererek parçalanır. Proses çevrimseldir (Şekil-3); oluşan bu karbon dioksit tekrar fotosentez reaksiyonuyla yeni biyokütleler oluşturularak tüketilir, dolayısıyla atmosferdeki karbon dioksit miktarı değişmez.
Fotosentez gibi çok yararlı bir işlev yapan atmosferdeki
karbon dioksit aynı zamanda yeryüzünü ısıtır. Ancak fosil yakıtlar nedeniyle
gereğinden fazla oluşması “global iklim değişikliklerine” neden olur. Oysa
biyokütle yandığında, “organik karbon” içerdiğinden, fosil yakıtlarından farklı
olarak atmosferdeki sera gazlarını artırmaz, üretilirken ve kullanılırken
atmosferdeki karbon dioksit konsantrasyonunu aynı düzeyde tutar, sülfür ve
nitrojen oksitleri emitlemez.
6.4.2. Prosesler
Biyokütle-biyoenerji dönüşüm prosesleri çeşitlidir
(Tablo-3); genel olarak termokimyasal, biyokimyasal (anaerobik ve aerobik
fermentasyon) ve fotobiyolojik dönüşüm prosesleri olarak üç grup altında
toplanabilir.
Termokimyasal dönüşüm prosesleri biyokütlenin ara
bileşiklere veya ürünlere parçalanmasında ısı enerjisi ve kimyasal
katalizörlerin kullanıldığı proseslerdir. Örneğin, gazlaştırma prosesinde
biyokütle az oksijenli bir ortamda ısıtılır, H2+CO karışımı bir gaz
elde edilir. Piroliz prosesinde biyokütle, havasız koşullarda yüksek
sıcaklıklar uygulanarak parçalanır. Biyokimyasal dönüşüm organik yapılı kaynaklardan
fermentasyon veya anaerobik parçalanmayla yakıtlar ve kimyasal maddelerin
üretilmesidir.
Tablo-3: Bazı Biyokütle
Teknolojileri Ve Prosesleri
Teknoloji
|
Proses
|
Temel Biyokütle
Hammadde |
Üretilen Enerji veya Yakıt
|
Biyokütle Yakma
|
Termokimyasal
|
Odun, tarım atıkları, kentsel katı
atıklar
|
Isı, buhar, elektrik
|
Biyodizel Üretimi
|
Kimyasal
|
Kolza tohumu, soya fasulyesi, atık
bitkisel ve hayvansal yağlar
|
Biyodizel
|
Etanol Fermentasyon
|
Biyokimyasal
|
Şeker ve nişasta döküntüleri, odun
atıkları, kağıt hamuru çamurları, kuru otlar
|
Etanol
|
Piroliz
|
Termokimyasal
|
Odun, tarım atıkları, kentsel katı
atıklar
|
Sentetik fuel oil (biyoyağ), odun
kömürü
|
Gazlaştırma
|
Termokimyasal
|
Odun, tarım atıkları, kentsel katı
atıklar
|
Orta-düşük enerjili üretim gazı
|
Metanol Üretimi
|
Termokimyasal
|
Odun, tarım atıkları, kentsel katı
atıklar
|
Metanol
|
DME
|
|||
Fischer-Tropsch dizel
|
Kimyasal
|
Biyodizel
|
|
Metan Fermentasyon
|
Biyokimyasal
|
Biyokütle veya biyokütleden elde edilen bileşikleri
istenilen ürünlere dönüştürmek için biyokatalizör olarak enzimler ve
mikroorganizmalar kullanılır. Selüloz ve he
miselüloz enzimleri hidroliz prosesiyle biyokütlenin
karbonhidrat fraksiyonlarını 5-6 karbonlu şekerlere parçalar. Maya ve bakteri,
şekeri metanole fermente eder.
Fotobiyolojik dönüşüm prosesleri organizmaların doğal
fotosentetik özellikleriyle güneş ışığından biyoyakıtlar üretimine dayanır;
örneğin, su ve güneş ışığından hidrojen elde etmek için bakteri ve yeşil
alglerin fotosentetik aktivitelerinden yararlanılır.
1. Biyokütle
Yakma
Doğrudan Yakma
Odun, kağıt ve zirai atıklar gibi bazı biyokütle kaynakları
katı halde kullanılırlar; briket ve pelletler, odun kömürü veya yardımcı-yakıt
olarak.
Biyokütleyi briket ve pelletler haline getirmek için yüksek
sıcaklıklar ve çok yüksek basınçlar uygulanır; biyokütle tanecikleri bir kalıp
içinde sıkıştırır. Elde edilen ürünlerin hacmi orijinal biyokütleden oldukça
küçük ve dolayısıyla volumetrik enerji yoğunluğu da daha büyüktür. Ayrıca
taşınması ve depolanması daha kolaydır. Briket ve pelletler endüstride
kullanılabilir, evlerde sobalarda odun yerine yakılabilir, veya odun kömürü
elde edilebilir. Evlerde mutfak işleri ve ısınma amacıyla biyokütle
kullanımında, tüketim yöntemine göre %30-90 enerji kaybı olabilir; bunu yenmek
için yüksek verimli sobalar kullanılmalıdır.
Odun kömürü, biyokütlenin çok sınırlı oksijenli bir ortamda
yakılmasıdır (piroliz). Modern odun kömürü fırınlarının sıcaklığı ~600 0C
dolayındadır ve kuru biyokütle bazında verim %25-35 aralığında değişir.
Fırından çıkan gazlardan tuğla veya kireç ocaklarının kurutulmasında
yararlanılır.
Biyokütle, genellikle bir fosil yakıtı olan taş kömürle
yardımcı yakıt olarak %5-15 arasında karıştırılarak yakılabilmektedir. Yeni
geliştirilmekte olan bu teknolojilerle geleceğin ekonomik bir yakıt türünün
geliştirilmesi hedeflenmektedir. ‘Ko-firing’ denilen bu teknoloji halen buhar
ve elektrik üretimi yapılan bazı güç ünitelerinde uygulanmaktadır. Böylece
yanma sonucu oluşan emisyon gazlarında (SO2, CO2, NOx)
önemli derecelerde azalma sağlanmaktadır.
Dolaylı Yakma Metodu
Bu yöntemde biyokütle düşük basınç altında, indirekt
gazlaştırmayla orta derecelerde ısı değerli biyogaz elde edilir. Uygulanan
teknolojilerden biri Şekil-5‘de verilen akım diyagramında görülmektedir.
Katı biyokütle kumla sarılır ve kumun ısıtılmasıyla akışkan
yataklı bir reaktörde 1500-1600°F’da gaz ve kömürleşmiş kalıntıya dönüşür.
Burada kum ısı banyosu, ısı dağıtıcı ve taşıyıcıdır; gazlaştırma sistemine hava
girmesini önler. Üretilen biyogaz, doğrudan yakma yöntemine kıyasla daha iyi
kalitededir.
İkinci reaktör yakma reaktörüdür; kumla karışık kömürleşmiş
kalıntı burada hava akımında yakılır. Gazlaştırma sırasında oluşmuş olan az miktardaki
yoğunlaşabilen maddeler bir ayırıcıda katalizörle parçalanıp gazlaştırılır ve
tekrar gazlaştırma reaktörüne verilir. Elde edilen biyogaz orta enerjili ve
temiz bir gazdır; elektrik üretimi için gaz türbinlerine verilmeden önce
basınçlandırılır.
2. Biyodizel
Üretimi
Biyodizel, petrol bazlı dizel yakıtına alternatif olarak son
yıllarda geliştirilen ve yağlı taneli bitkilerden veya atık bitkisel ve
hayvansal doğal yağlardan elde edilen mono-alkil ester karışımlarıdır. Doğal
yağlar arasında yeni veya kullanılmış ayçiçeği, kolza, soya fasulyesi yağları
ile hayvansal fatler örnek olarak sayılabilir. Biyodizelin ilginçliğinin asıl
nedeni yenilenir bir enerji kaynağı olmasıdır.
Sentez Gazı Sıvılaştırma proseslerinde, biyokütlenin
gazlaştırılarak sentez gazına (H2+CO) dönüştürülmesiyle elde edilen
biyogaz gaz iki yöntemle biyodizel özelliğinde yakıta dönüştürülebilir.
·
Fischer-Tropsch katalizörüyle sıvılaştırılarak
dizel yakıtı özelliğinde bir yakıta dönüştürülebilir; buna “Fischer-Tropsch
dizel”i denir (6.1.1. Biyogazdan
Fischer-Tropsch Dizel yakıtı)
·
Katalitik bir prosesle önce metanol, sonra
transesterifikasyon prosesiyle biyodizel elde edilir
Biyodizel üretimi kimyasal bir dönüşüm prosesidir.
Kullanılmakta olan iki önemli üretim prosesi, mekanik presleme ve solvent
ekstraksiyon prosesleridir. Ayrıca sentez gazı sıvılaştırma prosesleriyle de
biyodizel üretilme mümkündür.
Mekanik presleme prosesinde taneli yapılı hammadde önce ~110
0F dolayında ısıtılır, sonra vidalı bir preste sıkıştırılıp
parçalanarak yağı çıkarılır, alınır ve atık posa hayvan yemi olarak kullanılmak
üzere toplanır.
Solventle ekstraksiyon prosesinde, mekanik parçalamaya
kıyasla yağlı tanelerdeki yağın daha fazlası çekilir ve elde edilen yağ daha
saftır. Proseste yağı çözen bir solvent kullanılır. Ekstraksiyon işleminden
sonra yağ ve solvent distilasyonla birbirinden ayrılır; solvent tekrar
kullanılmak üzere resaykıla alınır.
Kolza tohumu, mısır ve ayçiçeği gibi bitkisel yağlar elde
edildiği şekliyle dizel yakıtı olarak kullanılabilir. Ancak transesterifikasyon
prosesiyle bu yağların viskoziteleri düşürülerek çok daha kaliteli dizel yakıtı
üretilir.
Transesterifikasyon reaksiyonunda bitkisel yağ, uygun bir
katalizör varlığında bir alkolle
(metanol veya etanol) reaksiyona sokulur. Hammadde kolza tohumu ise reaksiyon
ürünleri gliserin ve kolza metil (veya etil) esteridir. Ürün ester doğrudan
biyodizel yakıtı olarak kullanılabileceği gibi petrol bazlı dizel yakıtıyla
harmanlanarak ta kullanılabilir. Yağlar ve fatlerden alkil esterlerin üretiminde
üç temel proses kullanılmaktadır:
·
Yağ ve alkolün bazla katalizlenmiş
transesterifikasyon reaksiyonu
·
Yağ ve alkolün doğrudan asitle katalizlenmiş
esterifikasyonu
·
Yağın önce fatty asitlere dönüştürülmesi ve asit
katalizörlüğünde alkil esterlerin elde edilmesi
Biyodizel emisyonlarında, normal dizele göre partikül
tanecikler, hidrokarbonlar ve CO daha düşük, NOx in biraz daha fazladır.
Biyodizelin (ASTM D6751) kimyasal ve fiziksel özellikleri geleneksel dizel
yakıtına çok benzer. Tablo-4' de soya fasulyesinden elde edilen biyodizel ve
petrol esaslı düşük sülfürlü dizel yakıtının özellikleri verilmiştir.
Bugün uygulanan proses bazla katalizlenmiş reaksiyonlardır.
Çünkü bu proses çok ekonomiktir, düşük sıcaklıkta (150 0F) ve
basınçta (20 psi) yapılır, yüksek verim (%98) alınır, reaksiyon süresi kısadır,
yan reaksiyonlar en az düzeydedir ve ara kademeler olmaksızın doğrudan metil
ester dönüşümü gerçekleşir.
ROH, kısa zincirli bir alkoldür (metanol, bazen etanol), R’,
R’’, R’’’ oil veya fatteki faty asit zincirlerini gösterir; doğal yağlar veya
fatlerde bunlar palmitik, stearik, oleik linoleik asitlerdir. Bu dönüşüm
prosesinin genel akım şeması Şekil-6’da görülmektedir. Bazla katalizlenmiş
biyodizel üretiminde genellikle aşağıdaki proses sırası izlenir.
Katalizör sodyum (kostik soda) veya potasyum hidroksittir
(potas), standart bir çalkalayıcı veya karıştırıcıda alkolle karıştırılarak
çözülür. Reaksiyon: Alkollü katalizör kapalı bir reaksiyon kabına alınır, yağ
veya fat ilave edilir. Alkol kaybı olmaması için sisten bu andan itibaren
atmosfere kapatılır. Reaksiyon sıcaklığı, alkolün kaynama noktasının üstünde
(~160 0F) tutulur. Önerilen reaksiyon süresi 1-8 saattir. Bazı
sistemlerde reaksiyon oda sıcaklığında yapılır. Reaksiyonun tam ve hızlı olması
için alkolün fazlası kullanılır. Serbest yağ asitleri ve su seviyeleri monitörlerle
kontrol altında tutulmalıdır; bunların yüksek olması sabun oluşmasına neden
olur.
Reaksiyon tamamlandığında iki ürün oluşur; gliserin ve biyodizel.
Metanol fazlası kullanıldığından her ikisi metanol içerir. Karışım bazen bu
kademede nötralleştirilir. Gliserin fazı biyodizelden daha yoğun olduğundan
çöktürme kabının dibinde gliserin alınarak fazlar ayrılır. Ayırma işlemi daha
hızlı olarak bir santrifüjle de yapılabilir. Gliserin ve biyodizel fazları
ayrıldıktan sonra her iki fazdaki fazla alkol flash evaporasyonla veya
distilasyonla uzaklaştırılır. Veya, önce alkol distilasyonla ayrılır ve
gliserin ve esterler ayrılmadan önce karışım nötralleştirilir. Her iki proseste
de alkol tekrar kullanıma döndürülür. Yan ürün gliserin kullanılmamış katalizör
ve sabunlar içerir; asitle nötralleştirilerek ham gliserin tanklarına
gönderilir.
Gliserinden ayrılan biyodizel bazı proseslerde ılık suyla
yıkanarak kalıntı katalizör ve sabundan temizlenir, kurutulur ve depolamaya
verilir. Bazı proseslerde bu işleme gerek olmaz. Biyodizel berrak-amber
renklidir, viskozitesi normal dizel yakıtı gibidir. Proseste elde edilen
biyodizelin ve petrol bazlı dizel yakıtının özellikleri Tablo-4’de verilmiştir.
Tablo-4: Biyodizel
Ve Düşük Sülfürlü
Dizel Yakıtının Tipik Özellikleri
Dizel Yakıtının Tipik Özellikleri
Özellik |
Biyodizel B100
|
Dizel yakıtı
|
Biyodizel Testler, ASTM
|
Relatif yoğunluk, 15 0C
|
0.88
|
0.83-0.86
|
|
Alevlenme noktası, 0C
|
100
|
60
|
D 93, min. 100.0
|
Viskozite, 40 0C, mm2/sn
|
4.7
|
3.2
|
D 445, 1.9-6.0
|
Sülfür, % ağ.
|
<0.01
|
0.03
|
D 5453, maks. 0.05
|
Setan sayısı
|
48-52
|
45
|
D 613, min. 40
|
Alt ısı değeri, MJ/kg., 15 0C
|
44.0
|
42.7
|
Biyodizelin geleneksel dizel yakıtına göre bazı avantaj ve
dezavantajları vardır; biyodizelin,
·
Enerji içeriği, biraz düşüktür, fakat yol
performans testleri bunun önemli derecelerde olmadığını göstermiştir
·
Yağlayıcı özelliği iyidir, sülfürlü ve aromatik
bileşikler içermez
·
Akma noktası biraz yüksektir; bu özelliği soğuk
iklimlerde kullanılmasını sınırlandırır
·
Biyodizel biyolojik olarak kolay parçalanabilen
bir karışımdır; fakat bu özelliğinden dolayı depolama süresince biyolojik
çoğalma devam eder
·
Oksidatif bozunmaya daha yatkındır
·
Daha pahalıdır; fiyatı geleneksel dizel
yakıtının iki katına yakındır
3. Etanol
Üretimi
Etanol, çok geniş kullanım alanı olan bir yakıttır,
biyokütledeki karbonhidratların önce şekere sonra da bir fermentasyon
prosesiyle etanole dönüştürülmesiyle elde edilir.
Etanol üretimi için en ideal hammadde şeker kamışıdır; fakat
ekonomik yönden başka hammaddeler de tercih edilebilir. Örneğin nişasta bazlı
biyokütleler daha ucuzdur, odun gibi selüloz maddeler hem ucuz ve hem de kolay
sağlanabilir, ancak prosesleri pahalıdır.
Fermentasyon prosesinde, biyokütle (örneğin şeker kamışı)
önce parçalanır, su ve maya ile karıştırılır ve fermenter denilen büyük
tanklarda orta derecelerdeki sıcaklıklarda bekletilir. Maya şekeri parçalar ve
etanole dönüştürür. Karışımdaki alkol (%10-15) distilasyonla su ve diğer
safsızlıklardan ayrılır. Kalıntı posadan proseste ısı elde etmekte
yararlanılır.
Etanol üretiminde kullanılan iki önemli teknoloji,
·
Islak-öğütme (wett-mill)
·
Selüloz-etanol
prosesleridir.
a. Islak Öğütme Prosesi
Taneler temizlenir, ıslatılır ve öğütme işleminden
başlayarak tohumlar ayrılır, yıkama ve süzmeyle fiberler ve gluten
uzaklaştırılır. Bu kademelerde ayrılmayan nişasta, sıvılaştırma ve
sakkarifikasyon aşamalarında enzimlerle parçalanarak şekerler + su karışımına
dönüştürülür.
Şeker ve su karışımı (slurry) içine maya konulur;
fermentasyonla oluşan bira çözeltisi %10-12 alkol içerir. Bu dönüşüm prosesinin
hızı slurrynin içerdiği su miktarına ve asitliğine, sıcaklığa, oksijen
miktarına bağlı olarak değişir. Hammaddenin orijinal kuru ağırlığının üçte biri
fermentasyonu karbon dioksit olarak terkeder. Fermentasyondan sonra kalan katı
maddede hala bir miktar yararlı madde vardır ve tekrar hammadde olarak
kullanılabilir. Bira çözeltisi distillenerek %80-95 aralığında etanol içeren
etanol-su karışımı üretilir. Etanolün motor yakıtı olarak kullanılması için
içerdiği suyun uygun dehidrasyon metotlarıyla giderilerek %100 alkol haline
getirilmesi gerekir.
b. Selüloz-Etanol Prosesi
Bu teknoloji yeni kullanılmaya başlanmış olan lignoselülozik
hammaddelerin şekerlere ve şekerlerin de fermentasyonla etanole
dönüştürülmesinde uygulanan bir prosestir. Lignoselülozik hammaddelerin tümü
selüloz, hemiselüloz ve ligninden oluşur. Lignin, bitkilerde yapıştırıcı
görevindedir ve diğer bileşenleri birarada tutar. Biyokütlenin ön-işleminde
ayrılır ve tekrar biyokütle yakıt hammadde olarak kullanılır; yakılarak
prosesin diğer aşamalarında kullanılan ısı üretilir.
Selüloz ve hemiselülozların kimyasal bağlarını parçalamak ve
ligninin uzaklaştırmak için uygulanan birkaç yöntemi vardır. En çok uygulanan
yöntem seyreltik ve konsantre asit hidrolizi ve enzimatik hidroliz
Prosesleridir. Burada örnek olarak bir asit hidroliz prosesi ele alınmıştır.
Proseste iki hidroliz aşaması vardır; birinci ve ikinci
ön-işlemlemeler. Birinci ön-işlemlemede fermente olabilen maddeler seyreltik
asitle (~0.5%) 200 0C kadar sıcaklıklarda hidrolizleneek selülüzik
zincirler arasındaki hidrojen bağları kırılır, bileşiklerin yapıları bozulur.
Bu reaksiyonlar sonunda hemiselüloz, C5 ve C6 şekerlere
(özellikle ksiloz ve mannoz) dönüşür (sakkarifikasyon reaksiyonları).
Selüloz fraksiyonu daha dirençlidir ve daha kuvvetli
reaksiyon koşullarına gerek vardır; dolayısıyla birinci ön-işlemlemede sadece
tane büyüklüleri azalır ve yapısı kısmen bozulur. Selüloz fraksiyonundan glikoz
(C6 şeker) oluşması için ikinci ön-işlemleme (asit konsantrasyonu ~%2, sıcaklık
~120 0C) yapılır.
Prosesin bir sonraki kademesi şekerlerin enzimler
katalizörlüğünde etanole dönüştürülmesidir. Son aşama, elde edilen bira
çözeltisinin distillenerek %95 dolayında etanol içeren sulu karışımın elde
edilmesidir.
Etanol oktan sayısı yüksek olduğundan iç yanmalı motorlar
için ideal bir yakıt bileşenidir. Ancak setan sayısı oldukça düşüktür, bu
nedenle de dizel yakıtları için uygun bir kimyasal madde değildir; dizel
motorlarının injeksiyon sistemleri modifiye edilerek ve gerekli katkı maddeleri
ilavesiyle bu özellik (yani zayıf tutuşma özelliği) teknik olarak
çözümlenebilmektedir. Tablo-5’te etanol, etanol ürünü ETBE (etil tersiyer
bütil eter) ve kıyaslama amacıyla benzinin bazı özellikleri verilmiştir.
Tablo-5:Etanolün
Yakıt Özellikleri
Özellik |
Etanol
C2H5OH
|
ETBE
C4H9 O C2H5
|
Benzin
(~değerler)
|
Relatif yoğunluk, 15 0C
|
0.80
|
0.74
|
0.75
|
Buhar basıncı (RVP), kPa., 15 0C
|
16.5
|
28
|
75
|
Kaynama noktası, 0C
|
78
|
72
|
30-190
|
Oktan sayısı (RON)
|
119
|
118
|
97
|
Oktan sayısı (MON)
|
92
|
105
|
86
|
Setan sayısı
|
11
|
8
|
|
Hava/yakıt; kg hava/kg. yakıt
|
9.0
|
14.7
|
|
Alt ısı değeri, MJ/kg., 15 0C
|
26.4
|
36.0
|
41.3
|
·
Etanolün oktan sayısı normal benzinin oktan
sayısından daha yüksektir, bu özellik motorun yakıt verimini artırır
·
Etanolde oksijen bulunması motorda hem yüksek
verim ve hem de temiz yanma sağlar
·
Bir yakıtın uçuculuğunu tanımlayan RVP değeri
etanolde çok düşüktür; bu özelliği iç yanmalı motorlarda ilk çalıştırmada
(soğukta) bir dezavantaj olmakla beraber, yakıtın patlama riskini ve emisyon
gazlarını azaltmak yönlerinden avantaj sağlar
Yakıtın tamamı etanolden oluşuyorsa motor 20 0C’nin
altında çalışmaz, dolayısıyla ancak benzine belirli oranlarda karıştırılarak ve
motora yakıt injeksiyonunda bazı düzenlemeler yapılarak kullanılabilir.
4. Piroliz
Piroliz, katı haldeki biyokütleyi daha yararlı gaz ve sıvı
yakıtlara dönüştüren temel bir termokimyasal prosestir; biyokütlenin oksijensiz
veya çak az oksijenli bir ortamda yakılarak hidrokarbonlarca zengin gaz
karışımları, yağa-benzer sıvılar ve karbonca zengin katı kalıntıların elde
edildiği işlemlerdir. Katı kalıntı enerji yoğunluğu orijinal biyokütleden daha
yüksek olan odun kömürüdür.
Piroliz; orta sıcaklıklarda yüksek ısı transfer hızıyla ve
kısa alıkonma süresinde gerçekleşir.
Bu koşulları sağlayan çeşitli reaktör konfigürasyonları
vardır; bunlar arasında kabarcıklı akışkan yatak, sirkülasyon ve taşımalı
yatak, siklonik reaktörler sayılabilir. Kuru biyokütle bazında elde edilen sıvı
ürün “biyoyağ” verimi %75 (ağ.) dolayındadır; bu ürün yenilenir bir sıvı
yakıttır ve ayrıca kimyasal maddelerin üretiminde de kullanılabilen değerli bir
hammaddedir.
Biyoyağ elde etme prosesleri biyokütlenin yağlı bir sıvıya
dönüştürülmesi için uygulanır; örneğin, doğrudan hidrotermal sıvılaştırmada
biyokütle ve su karışımına yükseltilen sıcaklıklar (300-350 0C) ve
30 dakikalık alıkonma zamanında suyun sıvı fazda kalmasına olanak verecek
yeterli basınçlar (12-20 MPa) uygulanır. Organik dönüşümü kolaylaştırmak için
alkali ilave edilebilir. Elde edilen ana ürün oksijeni azaltılmış (%10 kadar)
organik bir sıvıdır. Esas yan ürün ise sulu çözünür organik bileşiklerdir.
5. Gazlaştırma
Rotası
Gazlaştırma, pirolize kıyasla daha yüksek sıcaklıklarda ve
daha fazla hava kullanılarak (gereken oksijenin sadece 1/3 ü kadar oksijen)
yapılan bir tür piroliz işlemidir; elde edilen ve biyogaz denilen karışım CO, H2
ve az miktarlarda CO2, N2, CH4 karışımıdır.
Tipik bir gazlaştırma rotası Şekil-11’de verilmiştir.
Biyogaz çeşitli amaçlarla kullanılabilir; ısı ve buhar
üretiminde yakıt olarak, iç yanmalı motorlarda veya gaz türbinlerinde elektrik
üretimi için, ve hatta otomotiv yakıtı amaçlı kullanım olanakları vardır.
Gazlaştırma-bazlı küçük modüler biyokütle sistemleri köy ve
kasaba gibi az nüfuslu yerleşim bölgelerine ve iş yerlerine elektrik ve ısı
enerjisi sağlamak amacıyla geliştirilmektedir. Biyokütle hammadde, ekonomik
olması bakımından, yerel olarak sağlanan odunsu kalıntılar, kırpıntı atıklar,
hayvan gübreleri gibi maddelerdir.
Küçük modüler biyokütle sistemleri gazlaştırma prosesiyle
katı haldeki biyokütleyi gaz haline dönüştürür. Elde edilen H2+CO
haz karışımı gaz türbinine veya elektrik jeneratörünü çalıştıran motora
verilmeden önce saflaştırılır. Türbinden veya motordan çıkan atık ısıdan da
yararlanılır.
Büyük kapasiteli gazlaştırma sistemi, biyokütlenin önce
basit kimyasal bloklara ayrılması, sonra bunların yakıtlara, çeşitli ürünlere,
güce ve hidrojene dönüştürülmesi esasına göre dizayn edilir. Sistemde temel
olarak hammadde hazırlanması, biyokütle gazlaştırıcı, bir gaz işlemleyici ve
temizleme üniteleri bulunur. Gazlaştırma reaksiyonundan çıkan sentez gazında
partikül maddeler ve diğer bazı kirlilikler vardır; gaz karışımının yakıt,
kimyasal madde veya güç üretim sistemlerinde kullanılmaya alınmadan önce
temizlenmesi gerekir.
Gazlaştırma genel olarak kademeden oluşur:
·
Ön işlemleme: Kurutma, pulverize etme ve elekten
geçirme
·
Gazlaştırma: Biyokütle hammaddenin 700-1200 0C.aralığında
yakılarak hidrojen, karbon monoksit ve karbon dioksite dönüştürülmesi
·
Şartlandırma: Reforming ve şift reaksiyonlarıyla
karbon dioksit uzaklaştırma işlemleri
Gazlaştırma sistemleri çeşitlidir; en çok kullanılan
sistemler üç grupta toplanabilir; bunlar, karşı-akımlı (veya updraft),
yardımcı-akımlı (veya, downdraft, co-flow) ve akışkan yataklı gazlaştırma
sistemleridir.
Karşı-Akımlı Gazlaştırıcılar: Biyokütle yakıt
reaktöre üstten, buhar veya hava (veya O2) alttan girer. Aşağı doğru
akan yakıt, yukarı çıkan sıcak gazlar tarafından parçalanır. Oluşan odun
kömürünün bir kısmı alttaki kafese düşer ve orada yanarak ısı, CO2
ve su buharı verir; CO2 ve H2O diğer kömürleşmiş
tanelerle reaksiyona girer, CO ve H2 gazlarına dönüşür. Gazlar
reaktörün tepesinden, kül alttan alınır. Bu proses basittir, yüksek miktarlarda
kül ve nem içeren biyoyakıtlarla çalışılabilir. Ancak elde edilen gazda %10-20
kadar katranımsı sıvılar vardır, dolayısıyla araba motorlarında ve türbinlerde
kullanıma uygun değildir.
Yardımcı-Akımlı Gazlaştırıcılar: Bu proseste
biyokütle yakıt önce bir kurutucudan geçirilerek nem miktarı %20’nin altına
düşürülür. Yakıt ve hava (veya oksijen) reaktöre üstten girer, aşağı doğru
akarken tutuşur, yanar ve kömürleşmiş kalıntıyı terkeder. Orijinal yakıtın
%5-15 kadarı olan odun kömürü yanma gazlarıyla etkileşerek CO ve H2
çıkar. Bu gazlar aşağı doğru akar ve reaktörün altından çıkar. Gazlaştırıcıyı
terkeden biyogaz 700 0C dolayındadır. Yanma sonunda oluşan kül
alttan alınır. Bu prosesin avantajı üretilen biyogazdaki katran miktarının çok
az olmasıdır.
Akışkan Yataklı Gazlaştırıcılar: Akışkan-yataklı
gazlaştırıcı prosesinde reaktörde inert bir granüler yatak (silika veya seramik
gibi) bulunur. Biyokütle yakıt küçük taneciklere ufalanır (veya öğütülür) ve
gazlaştırma reaktörünün altından belenerek yüksek hızlı hava akımıyla yukarı,
ısıtılmış akışkan yatağa doğru akıtılır; yatak, yakıtı tutuşturacak, yakacak ve
gazlaştıracak sıcaklıktadır; piroliz ve kömürün dönüşümü (CO + H2
gazlarına) bu bölgede gerçekleşir. Prosesin çeşitli biyokütlelere uygulanabilme
gibi bir avantajı olmasına karşın kullanılan hammaddenin tana büyüklüğünün 10
cm den daha uzun, nem miktarının da %65’ten fazla olmaması gerekir.
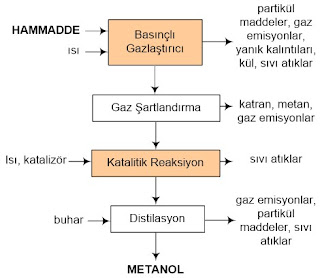
6. Metanol Üretimi
Biyokütleden metanol (odun alkolü de denir) üretimi
termokimyasal bir dönüşüm prosesidir. Hammadde esas olarak odun ve tarım
atıklarıdır; 1 ton biyokütleden yaklaşık olarak 186 galon metanol elde edilir.
(Ancak günümüzde metanol üretiminin hemen hemen tamamı doğal gazdan
yapılmaktadır; 1 galon metanol için 100 feet3 doğal gaz gerekir.)
Yüksek basınç ve yüksek sıcaklık koşullarında biyokütle
gazlaştırılır, gaz ürünlerden (karbon monoksit ve hidrojen karışımı, sentez
gazı) katranlar ve metan uzaklaştırılır ve buhar varlığında katalitik
reaksiyonla metanol elde edilir ve distillenerek ayrılır.
Metanol iç yanmalı motorlarda olduğu gibi veya benzinle
belirli oranlarda karıştırılarak kullanılabilir.
Metanolün oktan sayısı yüksektir, ancak setan sayısı çok
düşüktür, dolayısıyla benzinli motorlar için uygun bir yakıt olmasına karşın
dizel motorları için uygun değildir.
Metanol, metanolden üretilen metil tersiyer bütil eter
(MTBE) ve petrol bazlı benzinin yakıt özellikleri Tablo-6‘de verilmiştir.
·
Metanolün oktan sayısı normal benzinin oktan
sayısından daha yüksektir, yani anti-vuruntu özelliği daha iyidir, dolayısıyla
motor verimi ve yakıt ekonomisi yönlerinden daha avantajlıdır
·
Metanolde oksijen bulunması motorda hem yüksek
verim ve hem de temiz yanma sağlar
·
Metanolün buhar basıncı benzinle kıyaslandığında
çok düşüktür; dolayısıyla iç yanmalı motorlarda ilk çalıştırmada (soğukta)
olumsuzluklar yaratır. Bu özellik, bu özelliği, etanolde olduğu gibi motorun
ateşleme sistemine yakıt injeksiyonunda yapılan düzenlemelerle yenilmektedir
·
Metanolün hava/yakıt oranı etanolden daha
düşüktür, dolayısıyla yanma sırasında aha az oksijene gereksinim olur
·
Yakıtın tamamı metanolden oluşuyorsa motor 10 0C’nin
altında çalışmaz, ancak benzine belirli oranlarda karıştırılarak kullanılabilir
·
Metanol zehirli, hafif alkol kokulu ve
tatsızdır. Kullanımı ve taşınması sırasında özellikle cilde ve göze temasından
kaçınılması gerekir
Tablo-6: Metanol,
MTBE Ve Benzinin Bazı Özellikleri
Özellik
|
Metanol, CH3OH
|
MTBE,
C4H9 O CH3
|
Benzin,
(~değerler)
|
Relatif yoğunluk, 15 0C
|
0.80
|
0.74
|
0.75
|
Buhar basıncı (RVP),
kPa., 15 0C
|
31.7
|
57
|
75
|
Kaynama noktası, 0C
|
65
|
55.3
|
30-190
|
Oktan sayısı (RON)
|
110
|
116
|
97
|
Oktan sayısı (MON)
|
92
|
100
|
86
|
Setan sayısı
|
5
|
8
|
|
Hava/yakıt; kg /kg.
|
6.5
|
14.7
|
|
Alt ısı değeri, MJ/kg.,
15 0C |
19.8
|
35.2
|
41.3
|
7. Dimetileter
(DME)
Dimetileterin yakıt olarak kullanılması üzerindeki
çalışmalar 1990’li yıllarda başlamıştır ve halen devam etmektedir. DME sentez
gazından veya biyokütleden üretilebilir. Biyokütleden DME üretimi, biyometanol
üretiminde olduğu gibi biyokütlenin gazlaştırılması ve elde edilen gaz
ürünlerin sentezi yoluyla yapılır. Örneğin, 3 ton biyokütleden (odunsu bazlı) 1
ton DME elde edilebilir; bu miktar hacimce yaklaşık olarak 1500 litredir. DME
katalitik dehidrasyon prosesiyle saf metanolden de üretilebilir; proses
metanolden su ayrılmasına dayanır. (Bak. Bölüm Doğal Gaz)
DME yüksek setan sayısı ve iyi tutuşma sıcaklığı
özellikleriyle dizel yakıtı olarak kullanılabilecek bir bileşiktir. Tablo-7’de
DME ve petrolden elde edilen dizel yakıtının yakıt özellikleri verilmiştir.
·
DME dizel yakıtına kıyasla biraz daha yüksek
setan sayısına sahiptir, dolayısıyla tutuşma sıcaklığı daha düşük ve motordaki
yanması daha temizdir; issiz yanar, motor gürültüsüz çalışır
·
Enerji içeriği yönünden bakıldığında DME’in
kalori değeri oldukça düşüktür; bu özelliği dizel yakıtın göre önemli bir
dezavantajdır
Tablo-7: DME ve
dizel yakıtının özellikleri
Özellik
|
DME,
CH3OCH3
|
Dizel,
(~ değerler)
|
Relatif yoğunluk, 15 0C
|
0.67 (20 0C)
|
0.84
|
Oto-tutuşma sıcaklığı, 0C
|
235
|
250
|
Setan sayısı
|
55-60
|
50
|
Hava/yakıt; kg hava/kg. yakıt
|
9.0
|
14.5
|
Alt ısı değeri, MJ/kg., 15 0C
|
28.4
|
42.7
|
8. Metan
(Anaerobik Fermentasyon) Üretimi
Anaerobik digesyon, nemli ve yeşil biyokütlenin oksijensiz
ortamda bakterilerle bozunarak biyogaz denilen metan ve karbon dioksit
karışımının elde edilmesi prosesidir. Kentsel katı atık maddelerin kontrollü
koşullarda anaerobik digesyonuyla yüksek verimlerde metan üretilebilir.
Biyogaz, hayvan gübresinin suyla karıştırılıp digester
denilen hava sızdırmaz bir kapta karıştırılarak ısıtılmasıyla da üretilir.
Metan fermentasyonu çeşitli mikroorganizma gruplarının bir dizi metabolik
etkileşimiyle gerçekleşir.
1. Hidroliz ve Asidojenesis
Birinci aşamadaki mikroorganizmalar salgıladıkları
enzimlerle polimerik maddeleri hidrolizleyerek glukoz ve aminoasitler gibi
monomerlerini oluştururlar; bunlar da küçük molekül ağırlıklı fatty asitler, H2
ve asetik asite dönüşür.
2. Asetojenesis ve Dehidrojenasyon
İkinci aşama hidrojen-üretici asetojenik bakterilerin,
önceki kadamede üretilen fatty asitleri
(örneğin propiyonik ve bütirik asitler) H2, CO2,
ve asetik asite çevirmesidir.
CH3CH2CH2COO-
+ 2H2O « 2 CH3COO-
+ 2H2 + H+
CH3CH2COO-
+ 3H2O « CH3COO-
+ HCO3- + H+ + 3H2
3. Metanojenesis: Metanojenler
Son grup olan metanojenik bakteriler aneorobik digesyonla H2,
CO2, ve asetattan CH4 ve CO2.üretir.
Metanojenler, ayrıca, format, metanol, metil aminler ve karbon monoksiti de
metana dönüştürebilirler.
4H2 + HCO3-
+ H + « CH4 + 3 H2O
EK-1
SERA ETKİSİ VE EKO SİSTEM
Seralar özellikle kış aylarında bitki yetiştirmek amacıyla
hazırlanan küçük, cam (veya benzeri) odalardır; güneş enerjisiyle ısınırlar.
Seranın cam panelleri güneş ışınlarının içeri girmelerine izin verir, fakat
ısının içerden dışarı çıkmasını engeller.
Atmosferdeki sera gazları, bir seradaki cam paneller gibi
davranırlar. Güneş ışığı atmosfere girer, sera gazlarınca oluşturulan
katmanları geçer ve yer yüzeyine ulaşır; burada enerjisi toprak, su ve biyosfer
tarafından absorblanır, ve sonra absorblanan bu enerji çeşitli yollardan tekrar
atmosfere döner. Atmosferdeki bu enerjinin bir kısmı uzaya dönerken, çoğu
atmosferdeki sera gazları tarafından tutulmuş olarak kalır ki, bu da dünyanın
ısınmasını sağlar. Sera gazları, atmosferdeki infrared ışını absorblayan
çeşitli gazlardır; bunlar arasında su buharı, karbon dioksit (CO2), metan (CH4),
nitrojen oksit (N2O), halojenli fluorokarbonlar (HCFC), ozon (O3),
perfluorokarbonlar (PFC) ve hidrofuoro karbonlar (HFC) sayılabilir.
Kısa dalgalı güneş ışınları atmosferden kolaylıkla geçer,
fakat yeryüzünün ısınmış yüzeyinden emitlenen uzun dalgalı infrared ışınlar
atmosferde bulunan eser miktarlardaki gazlar (özellikle su buharı ve karbon
dioksit) tarafından kısmen absorblanır ve tekrar emitlenir. Böylece çıkan
infrared ışın, güneşten gelen radyasyonu dengeler; yer yüzeyi ve atmosfer, her
ikisi de ısınır.
“Doğal” ve “aşırı” sera etkisi arasındaki farklılık
önemlidir. Doğal sera etkisi yer yüzeyinin ortalama sıcaklığını, bu etkinin hiç
olmaması durumuna göre 33 0C kadar yükseltir; bu oluşum canlıların
yaşam koşullarını olumlu yönde etkiler, mevsimlerin ve iklimin denge altında
olmasını sağlar. Aksi halde dünya çok soğuk olurdu ve yaşam çok zorlaşır, hatta
olanaksızlaşırdı.
Aşırı sera etkisi yeryüzünün sıcaklığının, olması gereken
ortalama sıcaklığından daha fazla yükselmesine neden olur, global ısınma, bunu
takiben kirlenme, iklim değişikleriyle karşılaşılır; örneğin şiddetli
fırtınalar, okyanusların seviyelerinde değişiklikler gibi.
Biyoenerji iklim değişiklikleri geçişine yardımcı olur, asit
yağmuru, toprak erozyonu, su kirlenmesi gibi olayları azaltır, hayvan ve bitki
ve ormanların yaşamını dengede tutar, ekolojik dengeyi sürdürür. Ekolojik
sistem içinde yeralan fosfor ve nitrojenli bileşikler (aminoasitlerde)
karbon-karbon bağı içermezler, bu nedenle “inorganik besinler” olarak kabul
edilirler.
Eko sistem içinde enerji ve inorganik besinlerin akışında
kabul edilen genel kurallar:
·
En yüksek enerji kaynağı güneştir
·
En fazla enerji ısı olarak harcanır
·
Enerji ve besinler, besin zinciriyle (bir
organizmanın diğerini yemesiyle), organizmadan organizmaya geçer
·
Bozundurucu bileşikler (dekompozerler) son
organizmalarda kalan enerjiyi uzaklaştırır, e. İnorganik besinler çevrime
girer, enerji ise girmez
Su Çevrimi: Su çevriminde, güneş enerjisi okyanus
yüzeylerinden ve ağaçlardan suyu buharlaştırır, bulutları (ki bunlar su
buharlarıdır) bir yerden diğer bir yere taşıyarak hava sistemini denetler.
Atmosferdeki gaz halindeki su yoğunlaşarak yeryüzüne çökelir; bunun tersi sıvı
suyun gaz haline geçmesi, buharlaşmasıdır.
Buharlaşan su yoğunluğu nedeniyle kısmen yer yüzeyinde
kalır, kısmen de yeraltına iner ve ilerleme okyanuslara kadar uzanır.
Karbon Dioksit (CO2) ve Karbon Çevrimi: Biyolojik
yönden karbon çevrimi solunum ve fotosentez olayının bir toplamıdır. Solunumla
karbonhidratlar ve oksijen alınır, birleştirilir ve karbon dioksit, su ve
enerji açığa çıkar. Fotosentezde karbon dioksit ve su birleşerek
karbonhidratlar ve oksijen üretilir. Yani solunumla çıkan ürünler fotosentezin,
fotosentezle çıkan ürünler de solunumun hammaddeleridir.
Nitrojen Oksit (N2O) ve Nitrojen Çevrimi:
Nitrojen oksit trofosferde inerttir, büyük bir kısmı stratosferde radyasyonla
fotolizlenerek, az bir kısmı da atomik oksijenle reaksiyona girerek parçalanır.
N2O + hv ® N2 + O < 341 nm
N2O + O ® N2 + O2 N2O
+ O ® 2NO
Nitrojen çevrimi, nitrojenin çok sayıda önemli bileşiği
bulunmasından ve organizmaların bu bileşikleri birbirlerine dönüştürmelerinden
dolayı karmaşık ve zordur. Vucudumuzdaki proteinlerin yaratıcısı amino
asitlerin amino kısmının oluşmasında nitrojenin kritik bir önemi vardır;
proteinler deri, kaslar ve tüm enzimlerin temel taşlarıdır. En büyük nitrojen
kaynağı %78 lik payla atmosferdir
Fosfor Çevrimi: Fosfor çevrimi basittir, tek bir
bileşiği, dört oksijen atomlu fosfat bileşiği etkilidir. Fosfatlı kayaçlar
suyla karşılaştıklarında fosfat bileşikleri suya geçer ve çeşitli gıdalar
tarafından tutulur. Fosfor hücre membranlarının, DNA, RNA ve ATP nin önemli bir
bileşenidir. Hayvanlar fosforu yedikleri bitkilerden, bitkiler de bir tür
mantardan alırlar. Hayvanlar fosforu kemik, diş ve kabuklarının oluşumunda kullanırlar.
Bitki ve hayvan öldüğünde fosfat bileşikleri toprağa ve suya döner, ve tekrar
diğer bitkilerce kullanılmaya başlanır.
Metan (CH4): Metan atmosferdeki hidroksil
radikalleriyle etkileşerek metil radikaliyle suya dönüşür.
CH4 + OH ® CH3 + H2O
Klorofluorokarbonlar (CFC-11 and CFC-12): CFC-11 ve
CFC-12 bileşikleri trofosferde kimyasal olarak inerttir, stratosfere
difüzlenirler, radyasyonla fotoliz ve atomik oksijenle kimyasal reaksiyona
girerek parçalanır.
CCl3 F + hv ® CCl2 F + Cl,
< 265 nm
CCl2 F2 +
hv ® CC lF2 + Cl,
< 200 nm
CCl3 F + O ® CCl2 F + ClO
CCl2 F2 +
O ® CCl F + ClO