Doğal gaz modern yakıtlarda istenilen tüm gereksinimleri karşılayan bir yakıttır; verimlidir, temiz yanar, ekonomiktir ve kontrol edilebilir.
Doğal gaz temel maddesi metan olduğundan yandığı zaman sadece su ve karbon dioksit oluşur. Oysa kömür ve petrol ürünleri gibi yakıtlar yüksek karbonlu, sülfürlü ve nitrojenli kompleks moleküller içerdiklerinden yanma ürünleri çevreye zararlı organik maddeler, sülfür ve nitrojen oksitler gibi emisyonlarla kül tanecikleri verir.
Doğal gaz yüzlerce yıldır çeşitli sektörlerde kullanılan bir enerji kaynağıdır; tüketimiyle ilgili istatistik verilere bir örnek olarak Şekil-1’de 2000 yılında USA’da kullanılan toplam enerjinin enerji kaynaklarına göre dağılımlarıyla, yine aynı yılda doğal gaz tüketimlerinin sektörlere göre dağılımı verilmiştir.
Dünyada üretilen doğal gazın ~%95’i,
- Tekrar petrol kuyularına injeksiyonda
- Elektrik üretiminde; güç ünitelerinde yakıt olarak
- Yerleşim bölgelerinde ve ticari kuruluşlarda çeşitli amaçlı yakıt olarak
- Endüstride buhar üretimi ve ısıtma operasyonlarında
- Dizel motorlarında alternatif yakıt olarak
- Yakıt hücrelerinde (Fuel Cells) elektrik üretiminde
Şekil-1:Toplam enerji tüketimi ve sektörlere göre doğal gaz tüketimi
1. Klorlanmış Metanlar
|
| ||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||
Klorometanlar metil klorür, metilen klorür (diklorometan), kloroform (trikloro metan) ve karbontetraklorür (tetraklorometan), metanın klorlandırılmasıyla üretilirler. Proseste klorometanların bir karışımı elde edilir; karışım distilasyon kolonlarında ayrılarak herbir bileşik ayrı ayrı elde edilir.
Karışımdaki bileşiklerin miktarları metan/klor mol oranı kontrol altında tutularak istenilen ürün lehine ayarlanabilir.
Örneğin, 350-370 0C sıcaklık ve atmosferik basınç altında CH4/Cl2=1.7/1.0 mol olduğunda elde edilen üründeki klorometanların dağılımı %58.7 metil klorür, %29.3 metilen klorür, %9.7 kloroform, %2.3 karbon tetraklorürdür.
Cl2
CH4 + Cl2 ¾® CH3Cl ¾®
Cl2 Cl2
CH2Cl2 ¾® CHCl3 ¾® CCl4 + 4HCl
CH4/Cl2=10/1 mol, sıcaklık 450 0C ve uygun bir katalizör varlığında ürün dağılımındaki metil klorür %80 olur. Karbon tetraklorür miktarının artırılması istendiğinde Cl2/CH4 oranı yükseltilir.
Metilen klorürün çeşitli kullanım alanları arasında aerosol, üretan köpüklerde şişirme maddesi, yağ ve boya temizleyici solventi olarak kullanımı oldukça yaygındır.
Kloroform, soğutucu olarak kullanılan klorodifluorometan (fluorokarbon 22) ve tetrafluoroetilen üretiminde kullanılan bir ara maddedir. Tetrafluoroetilenden, ısı ve kimyasal maddelere dayanıklı politetrafluoroetilen polimerleri elde edilir.
Karbon tetraklorür de kloroform gibi klorofluorokarbonların üeretiminde kullanılır; triklorofluorometan (fluorokarbon 11) ve diklorodifluorometan (fluorokarbon 12) aerosol olarak kullanılan kimyasal maddelerdir; parfüm, deodorant, saç spreylerinde, v.s., ile soğutucu gaz olarak.
2. Karbon Disülfür
|
| ||||||||||||||||||
Metan ve sülfürden karbon disülfür üretimi iki kademeli bir prosestir; ilk kademede metan ve sülfürden karbon disülfür ve hidrojen sülfür, ikinci aşamada yan ürün hidrojen sülfürden Claus prosesiyle sülfür üretilir. Reaksiyon sıcaklığı 675 0C, basınç 20-30 psig, katalizör aktiflendirilmiş aluminyum veya kildir.
CH4 + 4S ® CS2 + 2H2S
2H2S + O2 ® 2S + 2H2O
Toplam reaksiyon:
CH4 + 2S + O2 ® CS2 + 2H2O
Karbon disülfürün en önemli kullanım alanı rayon ve sellofan üretimidir. İkinci önemli kullanım yeri klor gazıyla reaksiyona sokularak karbon tetraklorür elde edilmesidir. Karbon disülfür ayrıca, perklorometil merkaptan, ksantatlar amonyum tiyosiyanat elde edilmesinde kullanılır.
3. Hidrojen Siyanür
|
| ||||||||||||||||||
Hidrojen siyanür metanın amonyak ve hava (oksijen) ile 1100 0C sıcaklık ve 20-30 psig basınç altında reaksiyonuyla,
2CH4 + 2NH3 + 3O2 ® 2HCN + 6H2O
veya, metan ve amonyağın platin katalizör varlığında 1200-1300 0C’da reaksiyona sokulmasıyla elde edilir.
CH4 + NH3 ® HCN + 3H2
Hidrojen siyanür çeşitli petrokimyasal maddelerin üretiminde kullanılır; bunlar arasında metil metakrilat, akrilonitril, adiponitril, akrilatlar, şelatlar ve sodyum siyanür sayılabilir.
4. Sentez Gazı
Sentez gazı, kömür veya doğal gazdan elde edilen ve daha sonraki uygulamalara bağlı olarak değişik miktarlarda CO ve H2 içeren bir gaz karışımıdır. Sentez gazının doğal gazdan elde edilmesi, kömürün gazlaştırılmasına kıyasla çok daha ekonomiktir.
Sentez gazı üretiminde pek çok kimyasal reaksiyon meydana gelir; basitleştirmek için bunlardan metanla ilgili olanlar aşağıdaki reaksiyonlarla gösterilebilir.
Sentez gazı üretiminde pek çok kimyasal reaksiyon meydana gelir; basitleştirmek için bunlardan metanla ilgili olanlar aşağıdaki reaksiyonlarla gösterilebilir.
Reforming (şiddetli endotermik)
(1) CH4 + H2O « CO + 3H2
(2) CH4 + CO2 « 2CO + 2H2
Yanma (kuvvetli ekzotermik)
(3) 2CH4 + O2 ® 2CO + 4H2
(4) CH4 + 2O2 ® CO2 + 2H2O
Şift dönüşüm (hafif ekzotermik)
(5) CO + H2O « CO2 + H2
Karbon
(6) CH4 ® 2H2 + C
(7) 2CO ® CO2 + C
Metandan CO ve H2 üretimindeki en önemli reaksiyonlar reforming (1) ve kısmi oksidasyon (3) reaksiyonlarıdır; birinciden elde edilen H2/CO oranı 3, ikincisinden ise 2 dir. CO2’ce zengin doğal gazlarda H2/CO = 1 olur (2); bu değer doğal gazdaki hidrokarbonların molekül ağırlıkları yükseldikçe düşer, ve son değer CO şift reaksiyonuyla (5) ayarlanabilir.
Sentez gazı üretiminde genel olarak üç proses uygulanır; buhar reformingi, katalitik ototermal reforming ve katalizörsüz kısmi oksidasyon prosesleridir.
Buhar reforming prosesi yüksek sıcaklık (~800-850 0C) ve yüksek basınçta (~500 psig) yapılan katalitik (örneğin, nikel bazlı) bir reaksiyondur (1). Proseste katalizör doldurulmuş, örneğin bir tüp dışarıdan ısıtılırken katalizörde karbon oluşumunun önlenmesi için fazla miktarda buhar verilir; su buharı ve karbon monoksit arasında meydana gelen şift reaksiyonu (5) hidrojence zengin sentez gazı üretilmesini sağlar. Gerekli ısının (H800 oC = +54.2 kcal) çoğu istenmeyen tam yanma reaksiyonuyla (4) sağlanır.
Katalitik ototermal reforming prosesinde hammaddeye oksijen ilave edilir; reaksiyon (1) için gereken ısının büyük bir kısmı, oksidasyon reaksiyonuyla (3) sağlanır; dolayısıyla üretilen sentez gazının H2/CO oranı düşüktür. Tüplü reforming prosesinde olduğu gibi, karbon oluşumunu azaltmak için ortama buhar ilavesi gerekir. Reaksiyonlar yüksek sıcaklıkta yapılır, dolayısıyla CO şift reaksiyonu da baskındır.
Kısmi oksidasyon prosesinde (katalizörsüz ortamda) (3) proses daha yüksek sıcaklıklarda (1300-1400 0C) ve çok yüksek basınçlarda (~2000 psig) gerçekleştirilir, oluşan az miktardaki karbon ortamda katalizör bulunmadığından önemli değildir ve buhar ilavesine gerek olmaz. Elde edilen sentez gazındaki karbon monoksit miktarı diğer iki prosese kıyasla daha fazladır.
Bir doğal gaz kısmi oksidasyon prosesinde (Şekil-2) hammadde doğal gaz ön ısıtıcıda 380 0C’a kadar ısıtılır, sülfürlü bileşiklerden arındırılır ve oksijenle beraber gazlaştırma reaktörüne verilir. Reaktörde 1300-1400°C’da kısmi oksidasyon reaksiyonuyla sentez gazı meydana gelir. Sıcak gazın ısısından yüksek basınçlı buhar elde edilmesinde yararlanılır. Katalitik olmayan proseste oluşan az miktardaki is bir sıyırıcıda yıkanarak uzaklaştırılır.
Şekil-2: Doğal gazdan kısmi oksidasyonla sentez gazı üretimi (Shell SGP)
Fischer Tropsch Sentezleri
Fischer Tropsch reaksiyonunda 1 mol karbon monoksit 2 mol hidrojenle reaksiyona girerek bir hidrokarbon zinciri başlatılır: karbon monoksitteki oksijen su oluşturarak ayrılır:
CO + 2H2® - CH2 - + H2O
ΔH = -165 kJ/mol
ΔH = -165 kJ/mol
Hidrokarbonlar elde edilebilmesi için H2/CO en az 2 olması gerekir; daha düşük olduğunda reaktörde katalitik su-gaz şift reaksiyonuyla oran ayarlanabilir.
CO + H2O ® CO2 + H2
ΔH = -42 kJ/mol
ΔH = -42 kJ/mol
Su-gaz şiftiyle katalizör kullanıldığında reaksiyonda açığa çıkan su CO ile reaksiyona girerek ilave hidrojen meydana gelir. Bu durumda en düşük H2/CO oranı 0.7 olmalıdır; CO’deki oksijen CO2 olarak çekilir:
2CO + H2 ® - CH2 - + CO2
ΔH = -204 kJ/mol
ΔH = -204 kJ/mol
Reaksiyonda çoğunluğu alifatik düz zincirler olan hidrokarbonlar (CxHy) oluşur; bunların yanında bir miktar dallanmış ve doymamış (olefinler) hidrokarbonlarla primer alkoller de meydana gelir.
Temel reaksiyonlar:
Alkanlar
n CO + (2n + 1) H2 ® CnH2n+2 + nH2O
Alkenler
n CO + 2nH2 ® CnH2n + nH2O
Su-gaz şifti
CO + H2O « CO2 + H2
Yan reaksiyonlar; Alkoller
nCO + 2n H2 ® H (- CH2-)n OH + (n-1) H2O
2CO ® C + CO2
Elde edilen sıvı ürünün bileşimi sıcaklık, basınç ve alıkonma süresi gibi proses parametrelerine, reaktöre ve katalizörlere göre değişir. Fischer Tropsch reaksiyonlarında kullanılan proses bağlı olarak uygulanan tipik sıcaklıklar 200-350 0C, basınçlar 15-40 bar aralığında değişir.
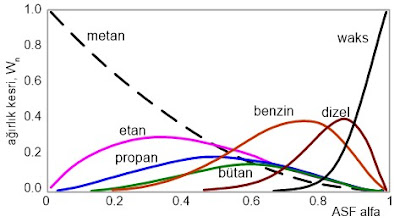
Peşpeşe devam eden Fischer Tropsch reaksiyonlarıyla, polimerizasyon reaksiyonlarına benzer şekilde uzun zincirler meydana gelir. Genellikle elde edilen ürünler metandan (CH4) başlayarak etan (C2), LPG (C3-C4), benzin (C5-C12), dizel (C13-C22), hafif yağlar (C23-C32) ve vakslara (>C33) kadar uzana geniş bir aralıktadır. Teorik zincir uzunluğu dağılımı Anderson-Schulz-Flory (ASF) eşitliği ile tanımlanır:
Wn (1-a)2
log ¾¾ n log a + log
n a
Wn = n karbon atomlu bileşiklerin kütle kesri, a = zincir büyüme olasılığını gösterir. Wn ve a değerlerine göre çizilen Şekil-3’deki grafikte görüldüğü gibi yüksek a değerleri yüksek molekül ağırlıklı ürünler oluşmasını sağlar.
Şekil-3: Teorik zincir uzunluğu dağılımı, Anderson-Schulz-Flory (ASF) eşitliği, Wn-alfa (a) eğrisi
a. Sentetik Yakıtlar
Genellikle hampetrolün rafinasyonuyla üretilen çeşitli yakıtlar (fuel gaz, LPG, benzin, nafta, dizel gibi) ve vakslar, doğal gazdan daha ekonomik elde edilir; iki üretim yöntemi: Fischer-Tropsch sentezleri ve metanol yoluyla üretimdir.
Her iki yoldan üretimde de ilk aşama doğal gazın sentez gazına dönüştürülmesidir; hidrojen, karbon monoksit ve karbon dioksit karışımı. Karışımdaki bu bileşiklerin miktarları seçilen doğal gaz dönüşüm prosesine ve elde edilmek istenen sentetik yakıtın türüne göre değişir; tipik karakteristik değer <1-3 arasında değişen H2/CO oranıdır.
Fischer-Tropsch teknolojisinde genellikle iki proses uygulanabilir; yüksek sıcaklık ve düşük sıcaklık prosesleri.
Yüksek sıcaklık prosesi 300-330 0C’da akışkan yatak demir bazlı katalizör üzerinden yapılır; benzin ve daha hafiflerle alkoller ve ketonlar gibi bazı kimyasal bileşikler elde edilir. Üretilen etilen, propilen, penten-1 ve heksen-1 çok saftır ve genellikle polimer endüstrisine satılır.
Düşük sıcaklık prosesleri 200-230 0C sıcaklıkta, kobalt veya demir bazlı katalizörlerle sabit yataklı reaktörlerde yapılır; yüksek sıcaklık proseslerine kıyasla daha fazla parafinik ve mumsu maddeler oluşur.
Örneğin, sentetik (green) dizel üretiminde proses koşulları dizel yakıtının bileşimindeki hidrokarbonlar üretilecek şekilde seçileceği gibi, yüksek verim elde edilmek istendiğinde, sentez parametreleri vakslara (yüksek adeğerlerinde) optimize edilir ve üretilen vakslar seçici parçalama (kraking) prosesiyle dizel bileşimine dönüştürülür (Şekil-4).
Şekil-4: Doğal gazdan sentez gazı ve Fischer-Tropsch reaksiyonlarıyla dizel yakıtı üretimi akım şeması
Metanolden çeşitli sentetik yakıtlar üretilir; örneğin, benzin bunlardan önemli bir tanesidir. Oktan sayısı (RON) 90-100 arasında olan süper benzin metanolün 260-410 0C sıcaklık, 300 psig basınçta zeolit tip katalizör üzerinden reaksiyona sokularak benzin hidrokarbonlarına dönüştürülmesiyle elde edilir.
n CH3OH ® CH3 – (CH2)n – CH3 + n H2O
Metanolün 260 0C’de silikon-zeolit katalizör üzerinden geçirilmesiyle aromatik bileşikler elde edilir.
Metanol ve sentez gazından kobalt katalizörle etanol, etanolün dehidrasyonuyla da etilen elde edilir.
Önemli bir proses metanolün sabit yataklı bir katalizör (zeolit esaslı) üzerinden önce düşük molekül ağırlıklı olefinlere, bu bileşiklerin de oligomerizasyon reaksiyonlarıyla istenilen bileşiklere dönüştürülmesidir.
Şekil-5: Metanolden sentetik yakıtlar üretimi blok diyagramı
Metanol
Sentez gazından metanol üretimi,
2 H2 + CO ® CH3OH DH0298 = -30.6 k kal/mol
reaksiyonuna göre gerçekleşir.
Metandan sentez gazı üretiminde 1 mol karbon monoksite karşılık 3 mol hidrojen elde edilir; oysa metanol sentezinde 1 mol CO için 2 mol H2 tüketilir. Fazla bir mol hidrojen metanol reaktörüne döndürülerek metanol veriminin artırılması sağlanır; hidrojen ortamdaki karbon dioksitle reaksiyona girer.
CO2 + 3H2 ® CH3OH + H2O
Metanol üretiminde doğal gaz en ekonomik hammadde olmasına rağmen doğal gazın bulunmadığı hallerde hafif petrol ürünleri, veya kömür hammaddeler de kullanılmaktadır.
Uygulanan basınca göre farklı prosesler vardır; örneğin, katalizör (Cu/ZnO/Al2O3) varlığında bir yüksek basınç prosesinde 4000-6500 psig ve 400 0C’da çalışılırken, alçak basınç prosesinde 725-1170 psig, 250-260 0C gibi bir sıcaklıkta çalışılır. Şekil-6‘da üç fazlı akışkan yatak reaktörde metanol sentezi akım şeması verilmiştir.
Şekil-6: Metanol üretimi akım şeması
a. Yakıt pilleri
|
| |||||||||||||||||||
Metanol yakıt pillerinde yakıt olarak kullanılır. Şekil-7 ‘deki diyagramda görüldüğü gibi, hammadde doğal gaz veya hidrokarbonlardan önce metanol elde edilir; metanolden, örneğin direkt metanol yakıt pillerinde (DMFC) saf metanol buharla karıştırılarak doğruda pilin anoduna verilir. Metanol, sıvıdır ve nakliyesi kolaydır, enerji yoğunluğu hidrojene göre yüksek olduğundan direkt metanol yakıt pillerinde yakıt depolama sorunlarıyla karşılaşılmaz.
Şekil-7: Doğal gaz (veya hidrokarbonlar), metanol, yakıt pili akım şeması
b. Kimyasallar ve Petrokimyasallar
MTBE, Asetik Asit, Formaldehit, Hidrojen Siyanür, Metil Klorür, Metilaminler, Metil Metakrilat, Dimetil Tereftalat (DMT)
Asetik Asit: Asetik asit ticari olarak çeşitli proseslerle elde edilir; örneğin, asetaldehitin oksidasyonu, n-bütanın oksidasyonu, metanolün karbonilasyonu bu proseslerden bazılarıdır.
|
| ||||||||||||||||||
Formaldehit: Formaldehit, metanolün katalitik oksidasyonuyla, propan-bütan karışımının non-katalitik oksidasyonuyla üretilir. Formaldehit normal şartlarda gaz halindedir, %37’lik sulu çözeltisi halinde satılır. Formaldehit kolay polimerleşen bir madde olduğundan çözeltiye bir miktar metanol konularak kararlı kalması sağlanır.
|
| ||||||||||||||||||
Metanolün oksidasyonla formaldehite dönüşümü reaksiyon mekanizması çalışma koşulları ve katalizör bileşimine göre değişir. Çok sayıda yan reaksiyonlar oluşur, ancak temel reaksiyonlar aşağıdaki gibi gösterilebilir.
CH3OH ® H-C(O)H + H2
DH0298 = +20.4 kkal
DH0298 = +20.4 kkal
2H2 + O2 ® 2H2O
DH0298 = -57.8 kkal
DH0298 = -57.8 kkal
Formaldehitin ara madde olarak kullanım alanları çeşitlidir. Bunlarda en yaygın olanı üre-formaldehit reçineleri, fenol-formaldehit reçineleri ve yapıştırıcı üretimidir.
Plastik endüstrisinde “heksamin”, farmasetik endüstrisinde “urotropin” adıyla tanınan madde, formaldehitin amonyakla reaksiyona sokulmasıyla elde edilen heksametilentetramindir (HMTA).
6H-C(O)H + 4NH3 ® (CH2)6N4 + 6H2O
Formaldehit ve asetaldehitin reaksiyonuyla elde edilen pentaeritritol, alkid reçinelerinin üretiminde kullanılan bir kimyasal maddedir.
4H-C(O)H + H-C(O)CH3 + NaOH ® C(CH2OH)4 + H-C(O)-Ona
Formaldehitin diğer bir kullanım alanı da etilen glikol üretimidir. Formaldehit ve karbon monoksit sulu ortamda reaksiyona sokularak önce glikolik asit elde edilir; glikolik asit metanolle esterleştirilir ve oluşan ester hidrojenlendirilerek etilen glikol ile tekrar metanole dönüştürülür.
H–C(O)H + CO + H2O ® HO-CH2-C(O)-OH
HO-CH2-C(O)-OH + CH3OH ® HO-CH2-C(O)-OCH3 + H2O
HO-CH2-C(O)-OCH3 + 2H2 ® HO-CH2-CH2-OH + CH3OH
Toplam reaksiyon:
H–C(O)H + CO + 2H2 ® HO-CH2-CH2-OH
Hidrojen Siyanür: Hidrojen siyanür doğrudan metan ve amonyaktan elde edilebileceği gibi, karbon monoksit, amonyak ve metanolden dolaylı olarak da elde edilebilir:
Toplam reaksiyon:
Metil Klorür (Monokloro metan): Metil klorür metanın klorlandırılması, gaz fazında metanol ve hidrojen klorürün reaksiyonu, veya sıvı fazda metanol ve hidroklorik asitin reaksiyonuyla elde edilebilir.
Toplam reaksiyon:
Metil Klorür (Monokloro metan): Metil klorür metanın klorlandırılması, gaz fazında metanol ve hidrojen klorürün reaksiyonu, veya sıvı fazda metanol ve hidroklorik asitin reaksiyonuyla elde edilebilir.
CH3OH + HCl ® CH3Cl + H2O
Reaksiyon gaz fazında ise sıcaklık 340-350 0C, basınç atmosferik, katalizör çeşitlidir. Sıvı faz reaksiyonu 100-150 0C aralığında, katalizör tercihen çinko klorürdür.
Metil klorür diğer kimyasal maddelerin üretiminde kullanılan bir ara maddedir; silikonlar, tetraetil kurşun bileşikleri, metil selüloz üretimlerinde kullanılır. Ayrıca bütil kauçuğu üretiminde solvent olarak kullanılır.
Metilaminler: Mono-, di- ve trimetilaminler metanol ve amonyağın katalitik reaksiyonuyla karışım halde üretilirler ve fraksiyonlayarak birbirlerinden ayrılırlar. NH3/CH3OH=2/1 (mol) olduğunda, 450 0C ve 200 psig basınçta karışımın ürün dağılımı %43 monometilamin, %24 dimetilamin ve %33 trimetilamindir. Bunlardan en çok kullanılanı dimetilamin olduğundan proseste monometilamin resaykıla alınarak dimetilamin verimi artırılabilir.
|
| ||||||||||||||||||
Monometilamin insektisid sentezinde, diğer pestisidlerin üretiminde ve farmasetik maddelerin elde edilmesinde kullanılır
Dimetilaminlerin kullanım yerleri çoktur ve çeşitlidir; bunlar arasında akrilik ve poliüretan fiberler için bazı solventlerin sentezi (dimetilformamid ve dimetilasetamid gibi), çeşitli yüzey aktif maddelerin ve kauçuk kimyasallarının sentezi, roket yakıtı olarak kullanılan asimetrik dimetil hidrazin üretimi sayılabilir.
Trimetilamin anyonik iyon değiştirici reçinelerin üretiminde kullanılır.
Metanol ve amonyaktan metil aminlerin sentezi
CH3OH + NH3 ® CH3NH2 + H2O
CH3OH + CH3NH2 ® (CH3)2NH + H2O
CH3OH + (CH3)2NH ® (CH3)3N + H2O
Metil Metakrilat: Metanol pek çok metil esterlerin üretiminde kullanılan bir kimyasal maddedir. Bunlardan metil metakrilat endüstriyel yönden önemli bir maddedir. Metil metakrilat sentezi bazik ortamda aseton ve hidrojen siyanür reaksiyonuyla başlar.
|
| ||||||||||||||||||
Amid tuzu metanolle esterleştirilerek metil metakrilat elde edilir.
Dimetil Tereftalat (DMT): Dimetil tereftalat tereftalik asitin metanolle esterleştirilmesiyle elde edilir; bu bileşiğin etilen glikolle transesterifikasyon reaksiyonuyla poliester fiberler ve filmler üretilir.
|
| ||||||||||||||||||
c. DME (dizel)
|
| ||||||||||||||||||
Metanol, gaz türbinlerinde yakıt olarak doğrudan kullanılabileceği gibi, dimetil etere dönüştürülerek de hem gaz türbinlerinde ve hem de dizel yakıtına alternatif bir yakıt olarak dizel motorlarında kullanılır. DME ayrıca dimetil sülfat elde edilmesinde ve aerosol olarak kullanılan önemli bir kimyasal maddedir.
2 CH3OH ® CH3 O CH3 + H2O
DME, eskiden yüksek basınç metanol sentezi sırasında yan ürün olarak elde edilirdi. Alçak basınç metanol sentezi proseslerinin uygulanmaya başlanmasıyla üretilen metanol uygun bir katalizör varlığında dehidrasyon reaksiyonuyla dimetil etere dönüştürülmektedir. Dehidrasyon prosesi sabit yataklı bir reaktörde yapılır; reaktör akımı soğutulur, distillenir ve saf DME elde edilir.
Şekil-8 basit ve ucuz bir metanol dehidrasyon prosesi akım şemasını göstermektedir. Böyle bir proseste istenilen her tür ve kalitede (örneğin, fuel gaz olarak veya güç üretimi üniteleri yakıtı gibi) DME üretilmesi mümkündür. Şartnamelerde belirtilen özellikler DME distilasyon kulelerinin büyüklüğü ve dizaynı değiştirilerek sağlanır.
Şekil-8: Metanol dehidrasyon prosesi akım şeması
d. Hidrojen
|
| ||||||||||||||||||
Metanol, hidrojen/karbon oranı yüksek olan çok verimli bir enerji taşıyıcıdır. Sıvı haldedir, kolay taşınır; üretildiği bölgeden alınarak hidrojen gereksinimi olan bir bölgeye taşınır ve kullanım yerinde dekompozisyonla hidrojen ve karbon dioksite parçalanır. Reaksiyon endotermiktir ve dışarıdan ısı verilmesini gerekir.
CH3OH (buhar) + H2O (buhar) ® 3H2 + CO2 - 49 kJ/mol,
CH3OH (buhar) ® 2H2 + CO - 95 kJ/mol (+su ile)
Etilen Glikol
|
| ||||||||||||||||||
Sentez gazından etilen glikol üretimi, aşağıdaki reaksiyona göre,
3CO + 5H2 ® HO – CH2 – CH2 – OH + CH3OH
Örneğin, 200 0C sıcaklık, 8000 psig basınç ve rodyum bazlı katalizörle üretilir. Yan ürün metanolün miktarı reaksiyon koşullarına göre değişir.
Amonyak
|
| ||||||||||||||||||
Sentez gazındaki hidrojen katalitik ortamda (potasyum hidroksitli demir oksit) azotla reaksiyona sokularak amonyak elde edilir; reaksiyon ekzotermiktir.
N2 + 3H2 « 2NH3
Azot inert bir madde olduğundan çift yönlü reaksiyon yüksek basınç ve yüksek sıcaklıklar uygulanarak denge reaksiyonu amonyak yönüne kaydırılır.
Proses sentez gazının H2/N2 = 3/1 olacak şekilde yeterli miktarda havayla karıştırılmasıyla başlar. İlk aşamada sentez gazındaki karbon monoksit şift reaksiyonuyla karbon dioksite dönüştürülür. Oluşan karbon dioksitin büyük bir kısmı, örneğin monoetanolamin ve sıcak potasyum hidroksit gibi bir absorblayıcı bir karışımla uzaklaştırılır, kalan CO2, gaz akımı 400-600 0C ve 100-350 atm.de nikel katalizör üzerinden reaksiyona sokularak metana dönüştürülerek ortamdan uzaklaştırılır. Metanatörden çıkan akımda H2/N2 = 3/1 dir.
Gaz akım sıkıştırılır (2000-5000 psia) ve 0 0C’ye kadar soğutulur. Reaksiyonda oluşan amonyak bir sıvı-gaz ayırıcıda 14.5 psia basınç ve –33 0C’ye soğutularak içerdiği safsızlıklardan arındırılır ve saf halde ayrılır. Reaksiyona girmemiş sentez gazı sıkıştırılır, ön ısıtmadan (180 0C) geçirildikten sonra tekrar sisteme döndürülür; böylece amonyak verimi %98’e kadar artırılabilir.
Şekil-10: Global amonyak temel kullanım alanları (A), ve üretim kapasiteleri (B) (2002)
GERİ (hampetrolden petrokimyasallara)